Quanti sono, in italia e nel mondo, gli oltranzisti della carbonara? Milioni? Nelle classifiche dei primi piatti migliori la carbonara ha sempre un posto vicino al vertice.
La carbonara è un piatto emblematico, capace di mettere tutti d’accordo sul piacere di mangiarlo, e al contempo ci fa litigare di brutto. Sempre in disaccordo su quale sia la ricetta originale, quella della tradizione, quella di mio cugggino di Roma che la fa meglio.
Nei ristoranti, ogni chef ha la verità in tasca ma nessuna combacia con quella dell’altro. Col guanciale, la pancetta no, è da scemi. Il Parmigiano è il simulacro del demonio, la panna per carità, roba da looser.
“Ma a me non piace l’odore di uovo crudo, e poi mi viene più cremosa!”
E allora chiamala pasta con uovo e panna.
Vi ricorda nulla?
Al di là dell’onanismo cerebrale e le beghe da pianerottolo, sembra che la carbonara non abbia origini vetuste. Pare sia andata in questo modo: la carbonara fu inventata nel 1944 da un cuoco laziale o romagnolo che condì degli spaghetti con le egg with bacon liofilizzate dei soldati americani.
Facciamo così, adesso vi dico la mia versione (qui trovate il video integrale), che funziona con i gastrotalebani integralisti e che funziona con i sovversivi.
Il naturale processo di evoluzione della cucina è quello in cui scienziati e cuochi lavorano in maniera simbiontica. La scienza ha tutte le risposte in grado di affinare e migliorare le tecniche in cucina. L’arte e l’estro del cuoco possono esistere solo dopo che questo ha davvero capito che cosa succede agli ingredienti quando vengono manipolati a livello molecolare.
Ho cercato in giro moltissime informazioni scritte da grandi scienziati prestati alla cucina.
Tre sono le fonti dalle quali ho raccolto praticamente tutto: On Food and Cooking, di Harold McGee, Culinary Biophysics di César Vega e La Scienza in Cucina del Professor Dario Bressanini.
Denaturazione e coagulazione
Da che cosa è composto l’uovo? Albume e tuorlo. Bianco e rosso. L’albume è prevalentemente costituito da proteine. Il tuorlo da proteine e grassi.
Che cosa succede quando somministriamo calore ad un uovo? Semplice: da liquido diventa solido. Il bianco da liquido traslucido trasparente diventa solido e opaco. Il rosso, da liquido viscoso e brillante diventa un solido arancione dalla consistenza sabbiosa. E fin qui ci arriviamo tutti.
Ma che cosa succede esattamente a livello delle strutture interne? Familiarizziamo con due termini che ci verranno a trovare ogni volta che ci capiterà di cuocere proteine: denaturazione e coagulazione.


Per spiegare bene il concetto di denaturazione proviamo ad immaginare uno di quei cavi arrotolati a forma di elica. Avete presente le cornette del telefono degli anni ’80? Immaginate che le proteine siano fatte un po’ in questo modo, a spirale.
La denaturazione è quel momento in cui tagliamo i legami agli estremi che obbligano l’elica a rimanere arrotolata. Una volta denaturate, le proteine possono “srotolarsi” e fare le loro cose insieme agli altri elementi.
La denaturazione può avvenire per via chimica, meccanica o termica.
L’acidita del limone, per esempio “cuoce” le proteine. L’albume montato a neve è un esempio di denaturazione per azione meccanica e la cottura dell’uovo al tegamino è un esempio di denaturazione e coagulazione per via termica.
Immaginiamo le proteine dell’uovo, come dei gomitoli di lana sospesi sul pelo dell’acqua. Inserendo sostanze acide, agitando l’acqua o aumentando la temperatura, alcune proteine cominciano a “srotolarsi” parzialmente: si “denaturano”.
La coagulazione invece è molto più evidente della denaturazione e si ha quando le proteine denaturate si separano dagli altri elementi e solidificano. Applicare calore per un tempo più o meno lungo fa in modo che le proteine creino una struttura che intrappola l’acqua e crea un gel, un solido morbido. Avete presente le uova strapazzate? La meringa? Ecco, quella roba lì.
Quando due proteine denaturate si incontrano nel mare in cui sono sospese, si possono legare tra loro e poco alla volta formano un reticolo tridimensionale solido, che intrappola l’acqua al suo interno: questa è la coagulazione. Se questo reticolo proteico diventa troppo fitto, finisce che l’acqua intrappolata viene “strizzata” fuori e ciò che rimane è un groviglio di proteine asciutte. Ecco spiegato l’uovo troppo sodo in cui l’albume sembra silicone e il tuorlo una pappetta di sabbia collosa.
Quattro punti fondamentali per capire la differenza fra coagulazione e denaturazione:
1° La denaturazione avviene SEMPRE prima della coagulazione. Prima srotolo, poi solidifico.
2° La coagulazione è un processo visibile. La denaturazione non lo è.
3° La coagulazione è possibile SOLO su proteine denaturate.
4° La coagulazione può essere controllata, la denaturazione no. Un po’ la differenza che c’è tra la manopola del volume e il tasto di accensione della radio. Posso stabilire quanto coagulare ma non posso stabilire quanto denaturare. Si può quindi sovracoagulare ma non si può sovradenaturare.
Facciamo un passettino avanti e occupiamoci di denaturare e coagulare le proteine dell’uovo per via termica. L’uovo e l’albume contengono diverse proteine. Non tutte si denaturano allo stesso modo e non tutte coagulano allo stesso modo. Coagulano a temperature diverse, alcune non coagulano affatto e alcune non si denaturano facilmente col calore.
Per semplificare le cose prenderemo in esame solo quelle che ci interessano. Partiamo dall’albume.
Le proteine più importanti sono 3:
Ovalbumina che rappresenta il 54% dell’albume, si denatura sia per azione meccanica che termica e coagula ad una temperatura minima di 84°C.
Conalbumina che rappresenta il 12% dell’albume, si denatura per azione termica e coagula a 61,5°C.
Ovomucina, non coagula ma stabilizza la schiuma.
Il tuorlo ha una struttura più complessa perché non è costituita solo da proteine. Il rosso d’uovo è fatto dal 50% di acqua, dal 32% di grassi e dal 16% di proteine. Questi grassi e queste proteine, di solito, sono però associate e legate insieme in particelle, che prendono il nome di lipoproteine. Il tuorlo è una dispersione di granuli in una massa acquosa. È già di suo, per conformazione naturale, un’emulsione, cioè una soluzione di acqua, proteine e grasso stabilizzata, grazie anche all’elevato contenuto di lecitine.
Del perché e percome il tuorlo d’uovo si solidifica ci importa fino a un certo punto. Ciò che è importante sapere è che le maggiori responsabili della capacità del tuorlo di diventare duro sono le lipoproteine LDL (Low Density Lipoproteins), che rappresentano all’incirca l’85% del totale delle proteine presenti nel tuorlo. Queste lipoproteine iniziano a coagulare a 65°C e finiscono di coagulare a 70°C.
Fissiamo un altro step importante nel nostro percorso verso la carbonara perfetta.
Alcune proteine dell’albume solidificano a 61 gradi e mezzo, ma la maggior parte a 84 gradi. La maggior parte delle proteine del tuorlo inizia a coagulare a 65° e finisce di coagulare a 70°C. Questo ci dice che gli stadi intermedi aumentano, man mano che sale la temperatura, la viscosità del tuorlo.
L’esperimento
Ho preso tre uova e le ho cotte in un bagno termostatico con tempi e temperature diversi, allo scopo di verificare i dati che erano in mio possesso.
Nel primo esperimento setto il bagno termostatico a 62 gradi e mezzo. Immergo l’uovo e lo lascio nella pentola per 75 minuti. Il risultato lo potete vedere da soli.

L’uovo cotto a 62 gradi e mezzo è evidentemente passato dallo stato trasparente a quello opaco. È molto morbido, ma è di fatto un solido. È evidente quindi che la Conalbumina, che coagula a 61 gradi e mezzo si sia coagulata e l’Ovalbumina, che coagula a 84 gradi, invece no. Il tuorlo è completamente liquido ma ha una fantastica consistenza mielosa, molto interessante. Palesemente più denso e viscoso del tuorlo crudo.

Ma facciamo un’altra prova.
Questa volta prendo un uovo e lo immergo in acqua a 67 gradi e mezzo, sempre per 75 minuti. Così per essere certo di denaturare tutta la conalbumina dell’albume e arrivare al punto di coagulazione intermedio delle lipoproteine del tuorlo.


Il risultato ci dà assolutamente ragione. L’albume è praticamente identico a quello dell’esperimento precedente, ma il tuorlo è in avanzato stato di coagulazione. È un solido morbido, di una consistenza quasi cerosa. Con ogni probabilità non fa al caso nostro, nello specifico non fa al caso della carbonara.
Ma già che ci siamo, spingiamoci oltre, arriviamo fino ai bastioni di Orione.
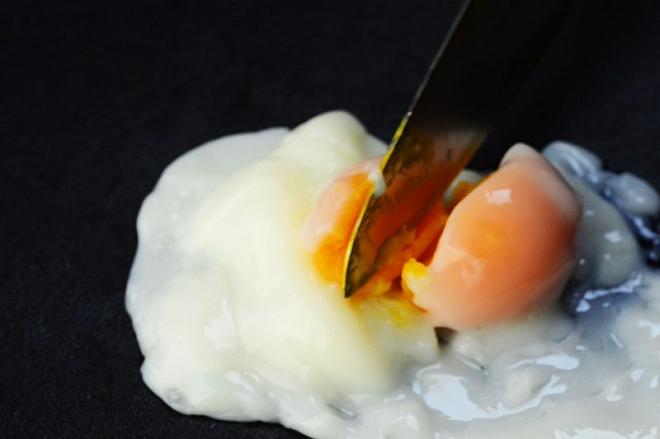
Prendiamo un terzo uovo e lo immergiamo per una decina di minuti in acqua a 100°C. Il risultato è che tutto è perfettamente coagulato. Tutte le proteine del tuorlo, perfettamente solido e sabbioso, e tutte le proteine dell’albume, che è diventato compatto.

Le conoscenze in nostro possesso sono state verificate. Ma facciamo l’ultima prova. Mettiamo un uovo a bollire per un tempo sufficiente a far coagulare l’albume, ma non sufficiente a raggiungere il tuorlo. L’idea è quella di agire, oltre che sul fattore temperatura, anche sul fattore “tempo”. Immergo un uovo a 100° ma stavolta per soli 6 minuti.
Sapete cosa succede?

L’alta temperatura ha perfettamente coagulato l’albume, ma non c’è stato abbastanza tempo per far penetrare il calore in profondità e permettergli di raggiungere il tuorlo. Che infatti è ancora liquido.
Per quanto mi riguarda sono a posto. Ho tutte le informazioni che mi servono e le prove che ho effettuato confermano i dati. Direi che possiamo passare alla formulazione della ricetta della carbonara perfetta, secondo me.
La carbonara perfetta

Voglio una salsa cremosa, senza grumi, che non sappia di pollaio dopo un acquazzone e che non abbia una consistenza viscida. Non voglio sentire il sapore dell’uovo cotto ma non voglio nemmeno avere la sensazione di mangiare pasta con la bava di lumaca. La soluzione si chiama zabaione salato: consiste nello scaldare le uova sbattute a bagnomaria insieme ad altri ingredienti. In questo caso, con il formaggio.
Ho scelto lo zabaione salato per 4 motivi fondamentali che senza alcun tipo di dubbio sono di supporto alla nostra causa.
1° – L’uovo come agente schiumogeno
Gli albumi sbattuti aumentano il loro volume fino a 8 volte e per questo potere schiumogeno hanno anche potere lievitante nei prodotti da forno. Immaginate il Pan di Spagna:le bollicine d’aria durante la fase di cottura si riscaldano e aumentano di volume formando gli alveoli, mentre le proteine coagulano e rinforzano la struttura.
2° – L’uovo come agente legante
Abbiamo visto che le uova sono viscose e coagulano in uno stato semisolido o solido. Questa loro caratteristica influisce sulla capacità di legare altri ingredienti; pensate alle crocchette di patate, all’hamburger o al ripieno dei tortellini. Sia l’albume che il tuorlo, con le loro proteine, possono addensare i liquidi. L’albume crea una struttura omogenea ed elastica mentre il tuorlo conferisce una struttura soffice e cremosa. Esattamente quello ci serve nella nostra salsa.
3° – L’uovo come agente emulsionante
I tuorli stessi sono una concentrata e complessa emulsione di grasso in acqua. Pertanto contengono al loro interno molecole emulsionanti come le lecitine. Queste hanno una parte idrofila che si lega all’acqua e una parte idrofoba che si lega ai grassi. In pratica fanno da collante fra tutti questi diversi elementi. Avete presente la maionese? Ecco, stesso principio.
4° – L’uovo come agente coagulante e gelificante
Le proteine dell’uovo, quando sono riscaldate, formano un reticolo in grado di inglobare i liquidi. Ad esempio nei budini, nella salsa inglese e nella crema pasticciera, l’aggiunta delle uova determina la gelatinizzazione del liquido.
Tornando a noi, scegliamo lo zabaione salato perché l’uovo scaldato e sbattuto avrà potere schiumogeno, legante, emulsionante e gelificante.
Lo zabaione salato

Dose per 6 persone:
4 tuorli d’uovo
2 uova intere
180 g di Parmigiano Reggiano 36 mesi
120 g di pecorino romano
Prendiamo due uova intere e 4 tuorli d’uovo. Un tuorlo a commensale, un uovo intero per il contenitore e un uovo intero sacrificato sull’altare della scienza. Questo ci garantisce il perfetto bilanciamento tra proteine, grassi, acqua e sapore esplosivo.
Le mettiamo in una bastardella e iniziamo a sbattere con una frusta. Il movimento meccanico ci dà la certezza di denaturare buona parte delle proteine. È lo stesso principio che sta alla base del tuorlo montato a neve.
Una volta denaturare, le proteine si srotolano, formano il reticolo, e imprigionano l’acqua e l’aria in piccole bollicine che rimangono legate fra loro.

A questo punto consideriamo 50 grammi di formaggio a persona. Voi fate come volete, io uso 20 grammi di pecorino romano e 30 grammi di Parmigiano Reggiano stagionato 36 mesi.
Aggiungo prima il pecorino e continuo a sbattere per amalgamare il tutto. Quando è ben amalgamato, aggiungo il Parmigiano. Continuando a sbattere mi accorgo che non sto facendo una salsa ma una sorta di mappazzone semi solido.
È assolutamente normale. Il bello viene adesso.
Prendo la mia bastardella e la metto in un tegame pieno d’acqua scaldata a 90 gradi. Deve sobbollire, non serve il bollore completo. Continuo a sbattere per qualche minuto e accade una strana magia. La conalbumina inizia a coagulare. L’ovomucina mi aiuta a stabilizzare l’emulsione ma soprattuto la lecitina contenuta nei tuorli.
Arriva la temperatura di fusione dei grassi del formaggio e come per incanto il mio mappazzone torna liquido. Oltre al grasso fuso, il motivo è dato proprio dall’alta presenza di grasso che in qualche modo rallenta la coagulazione delle proteine. Non demordo e vado avanti.
Continuo a sbattere per emulsionare e intrappolare quanto più aria possibile, voglio che la mia salsa sia spumosa e vellutata. La scaldo fino alla temperatura di coagulazione della conalbumina.
Ricordate il primo esperimento dell’uovo a bassa temperatura? Ecco. Voglio un albume morbido che non sappia di bava di San Bernardo. Voglio il tuorlo di una consistenza mielosa ma non coagulato del tutto. Ottengo questo risultato sbattendo il mio zabaione fino a quando non raggiunge la temperatura di 62°C e mezzo.
Quindi tolgo dal fuoco e faccio intiepidire, sempre sbattendo e girando. Quando scende sotto i 60°C rimetto sul fuoco e ripeto l’operazione. Faccio questa procedura per 5 volte, stando attento a non superare mai i 63°C.
Dopo la quinta volta, prendo la mia bastardella e la immergo in un recipiente con acqua e ghiaccio per “bloccare” lo stato di coagulazione dello zabaione salato.

Quindi taglio il mio guanciale o la mia pancetta, lo butto in padella e lo faccio diventare croccante.

Cuocio gli spaghetti e nel frattempo riscaldo una padella. Non serve che sia rovente, dev’essere ben calda per non rubare calore agli elementi che andremo a mescolare.
Ricordatevi di spegnere il fuoco prima di mettere gli altri ingredienti però. Due cucchiai di zabaione salato e uno di guanciale o pancetta sono la proporzione sufficiente per una singola porzione di pasta.
Scoliamo senza troppi fronzoli i nostri spaghetti nella padella, aggiungiamo un paio di cucchiai di acqua di cottura e mantechiamo. Qui potete fare come vi pare. La girate, la saltate, quello che conta è che la sbattiate come si deve per far uscire l’amido della pasta e creare la salsina cremosa.
Non vi fermate, se la padella è ben calda l’acqua si asciuga e l’amido viene fuori. Matematico.

Quando ottenete la consistenza che vi piace, la impiattate. Mettete gli spaghetti, mettete ancora un po’ di guanciale croccante e poi via col pepe.
Sì, ma quale.
Il pepe
Esistono mille possibilità, io ve ne dico 3.

Pepe Tellicherry Extra Bold. Bello, robusto e tanto aromatico.

Pepe Nero Lungo del Bengala. Non è un vero pepe, ma profuma tantissimo e pizzica pochissimo.

Pepe di Timut: è un pepe di Sichuan selvatico, con note agrumate importanti. Molto pungente, la particolarità è che intorpidisce leggermente la lingua.
Don’t try this at home
Chiudo dimostrando qual è il modo peggiore di fare la carbonara.

Mescolando la pasta con l’uovo sul fuoco, al salire della temperatura aumenta la coagulazione dei complessi proteici. Una volta raggiunti gli 88° C non ci sarà più nulla da coagulare (e da fare).
Avrete strizzato ogni goccia di umidità dalle uova e avrete ottenuto una splendida pasta con le uova strapazzate.
Conclusioni
Io ho finito, questa è la mia carbonara. Con me funziona tutte le volte, e tutti quelli a cui l’ho fatta provare l’hanno sempre piazzata tra le migliori carbonare della loro vita. Si può fare di meglio? Sicuramente sì.
Ciò che conta è capire che la cucina non sarà mai arte senza la scienza.
[Crediti | Link: Gianfranco Lo Cascio | Immagini e video: BBQ4All]
